Эффектная фотография, сделанная охотником за молниями Кэйном Куинелл. Эту молнию он сумел поймать во время шторма, происходившего за 5 — 10 миль от своего дома (Австралия). Как пишет об этом сам Кэйн, громовой раскат напугал его до смерти. К сайту www.kanequinnell.com подключится не удалось. Хочется верить, что блистательный фотограф не слишком увлекся своим опасным занятием. Однако, энергетический масштаб молнии не идет ни в какое сравнение с тем, что происходит даже в «слабой» ядерной бомбе. Вообразите, что тысячи молний с этого фото бушуют в коробке из-под пылесоса. Примерно так, только в рентгеновском спектре, выглядят первые микросекунды жизни бомбы ~1 кт ! Глава 3.0 NWFAQ Кэри Саблетта посвящена основам физики, которые помогут описать этот АД без помощи поэтического языка Данте.
Начало NWFAQ и список опубликованных на русском языке секций http://extremal-mechanics.org/archives/3047.
Эта секция дает основные знания фундаментальных физических явлений, которые управляют конструкциями ядерного оружия, особенно термоядерного оружия. Этот раздел не касается ядерной физики, которая была введена в секции 2 и обсуждается далее в секции 4. Вместо этого здесь рассматривается поведение вещества при высоких плотностях и температурах, а также законы, управляющие его потоками.
Хотя читатель может оказаться способным следовать за обсуждениями физики и дизайна в секции 4 без этого, знакомство с обсуждаемыми здесь принципами важно для глубокого понимания дизайна ядерного оружия. Поскольку одни и те же принципы имеют тенденцию периодически возникать в различных контекстах, и неудобно объяснять основы физики при рассмотрении инженерных вопросов, я даю обзор неядерных физических принципов, используемые ниже. Секция 2 содержит обсуждение используемых ядерных реакций.
Читатели с хорошей подготовкой в физике найдут многое из этого обсуждения слишком элементарными, чтобы быть интересным. Пропускайте пожалуйста все, с чем вы уже знакомы.
• 3.1 Термодинамика и свойства газов
3.1.1 Кинетическая теория газов
3.1.2 Теплота, энтропия и адиабатическое сжатие
3.1.3 Термодинамическое равновесие и Равномерное распределение
3.1.4 Релаксация
3.1.5 Закон распределения Максвелла-Больцмана
3.1.6 Теплоемкости и Термодинамический показатель
3.1.7 Свойства чернотельного излучения
• 3.2 Свойства вещества (ожидает перевода)
• 3.3 Взаимодействие излучения и вещества (ожидает перевода)
• 3.4 Гидродинамика (ожидает перевода)
• 3.5 Радиационная гидродинамика (ожидает перевода)
• 3.6 Ударные волны в неоднородных системах (ожидает перевода)
• 3.7 Принципы имплозии (ожидает перевода)
• 3.8 Неустойчивость (ожидает перевода)
3.1 Термодинамика и свойства газов
Термодинамика имеет дело со статистическим поведением большого собрания частиц, например значительного количества вещества. Буквальный смысл термина «термодинамика» подразумевает, что темой обсуждения является движение тепла. На самом деле термодинамика, прежде всего, рассматривает состояние теплового равновесия, где движение тепла уже прекратилось. Основным видом движения, представляющим интерес, является случайное движение самих частиц, что приводит к явлению, которое называется «теплом». Состояние равновесия именно этого, случайного движения может быть точно охарактеризовано с помощью статистических методов. Важно понимать, что темой термодинамики является изучение свойств вещества в той мере, в которой они являются тепловыми.
Есть два очень важных принципа термодинамики, называемых Первым и Вторым Законами. Часто они формулируется в виде:
1. Полная энергия во Вселенной является постоянной;
2. Энтропия Вселенной всегда возрастает.
В практических ситуациях более полезна формулировка Первого Закона, которая заключается в утверждении, что изменение полной энергии системы равно работе, проделанной над системой, плюс количество тепла, добавленного в систему. Второй Закон утверждает, что количество тепла в замкнутой системе никогда не уменьшается. Последствия этих законов обсуждаются ниже.
3.1.1 Кинетическая теория газов
Газообразное состояние является простейшей для анализа формой материи. Это большая удача, поскольку при тех экстремальных условиях, которые встречаются в химических и ядерных взрывах, вещество, как правило, можно рассматривать как газ, независимо от его плотности или исходного состояния.
Основные свойства газа могут быть выведены из рассмотрения движения составляющих его частиц (кинетическая теория). Давление, оказываемое газом на поверхность, вызывается отдельными молекулами или атомами, упруго отражающимися от этой поверхности. Это давление равно числу молекул, ударяющих поверхность в единицу времени, умноженному на средний импульс каждой молекулы, который нормален (то есть перпендикулярен) поверхности. Число ударов в секунду пропорционально (~) плотности частиц газа (, частиц в единице объема) и тому, как быстро движутся эти молекулы (средней молекулярной скорости
):
3.1.1-1
(momentum — это импульс, прим. переводчика). Средний импульс пропорционален на массу частицы
. Таким образом давление:
3.1.1-2
На самом деле мы можем утверждать, что:
3.1.1-3
т.к. вклад молекулярной скорости по нормали к поверхности в трех измерениях составляет 1/3 от квадрата ее величины.
Поскольку равно кинетической энергии частицы (
), мы также можем сказать, что :
3.1.1-4
То есть, давление пропорционально средней кинетической энергии частицы и плотности частиц, или равно двум третьим от общей кинетической энергии, , в единичном объеме газа (плотность кинетической энергии). Это обычно выражается как:
3.1.1-5 или
, где
- давление
Теперь то, что мы называем температурой, есть просто средняя кинетическая энергия частиц газа. Коэффициент пропорциональности используется для преобразования кинетической энергии, измеряемой в джоулях или эргах, в градусы Кельвина (К). Все вместе эти соображения дают нам Закон Идеального Газа:
3.1.1-6 , где
давление,
объем,
число частиц,
константа Больцмана (
эрг/K) и
температура,
- это, разумеется, плотность частиц (обозначаемая
).
Постоянный множитель 2/3 был поглощен постоянной Больцмана. В результате, если мы хотим выразить среднюю кинетическую энергию частиц газа при температуре , то мы должны сказать, что:
3.1.1-7
Идеальным газом (также называется совершенным газом) является тот, в котором нет взаимодействия (то есть, отталкивающих или притягивающих сил) между атомами. Для такого газа справедлив Закон Идеального Газа. В простейшем случае идеальный газ – это идеальный одноатомный газ, в котором вся энергия находится в форме движения частиц (т.е. сами частицы не поглощают никакой энергии). Это единственный случай, который мы рассматривали до сих пор. Гелий или аргон являются примерами идеальных одноатомных газов в очень хорошем приближении (они одноатомные, и силы притяжения становятся существенными только вблизи температур сжижения).
Молекулярные или многоатомные газы, в которых частицы являются молекулами из двух или более атомов, могут поглощать энергию через вращение и вибрацию. Такие газы не являются одноатомными, но они по-прежнему идеальны. При определенных условиях газы могут поглощать энергию в ходе других процессов, таких как ионизация, которые нарушают идеальное поведение газов. Если условия таковы, что силы притяжения становятся значительными (около точек жидкой или твердой конденсации) закон идеального газа также разрушается.
Идеальные одноатомные газы представляют для нас особый интерес, не только потому, что они особенно просты для анализа, но и потому, что при многих экстремальных физических режимах любое вещество имеет тенденцию вести себя, как идеальный одноатомный газ (кинетическая энергия доминирует над всеми другими видами энергии).
3.1.2 Теплота, энтропия и адиабатическое сжатие
Проще говоря, тепло является хаотическим движением частиц в веществе. В обиходе мы говорим о чем-то с более высокой температурой, как о более «горячем». Однако температура не является универсальной мерой того, что мы называем теплотой. Предположим, что мы взяли контейнер идеального газа и сдавливаем его, уменьшая объем. Чтобы сдавить его и сжать этот газ мы должны выполнить работу, которая, по Первому Закону Термодинамики, добавляется к внутренней энергии газа. Поскольку это идеальный газ, вся добавленная энергия проявляется, как кинетическая энергия. Это означает, что температура повышается. Мы действительно добавили тепла, чтобы сделать его горячее ?
Ответ — нет. Мы можем получить энергию обратно в форме работы, позволяя ему расшириться к первоначальному объему. Температура также понизится до исходного состояния. Этот процесс сжатия (называемый адиабатическим сжатием) является обратимым, поскольку мы можем вернуться к исходному состоянию.
Для повышения температуры в контейнере с газом без изменения его объема, мы должны поместить его в контакт с чем-то более горячим. Тепло диффундирует от горячего объекта к контейнеру. Поскольку газ в контейнере нагревается, более горячий объект остывает.
Как мы можем вернуть газ в исходное состояние ? Мы должны поместить его в контакт с чем-то, что холоднее, чем исходная температура газа. Тогда тепло диффундирует в более холодный объект. Хотя газ в контейнере теперь находится в исходном состоянии, вся система в целом — нет. Чем более горячий объект холоднее, тем более холодный объект теплее. Этот процесс является необратимым (мы говорим «энтропия системы увеличилась»).
Температура является мерой тепла в газе только при постоянном объеме. Обобщенной мерой тепла является энтропия. Энтропия определяется, как отношение полной энергии системы к ее температуре. По мере того, как тепло добавляется в систему, это отношение увеличивается. Работа, выполненная над системой, оставляет это отношение неизменным.
Адиабатическое сжатие есть сжатие, при котором энтропия постоянна (тепло не добавляется и не удаляется). Если происходят потоки тепла, то процесс не является адиабатическим и вызывает необратимые изменения.
3.1.3 Термодинамическое равновесие и Равномерное распределение
Я только что говорил о тепле, текущем от горячих объектов к более холодным. Этот процесс подразумевает, что система объектов стремится к состоянию, в котором все объекты находятся при одинаковой температуре. Когда это происходит, поток тепла прекращается. Такое состояние называется «термодинамическим равновесием», и все системы имеют естественную тенденцию эволюционировать к этому равновесию. Чем быстрее тепло может течь в системе, тем быстрее будет достигнуто это равновесие.
Идея термодинамического равновесия является чрезвычайно общей. Она применима не только к «объектам» — физически разделенным частям системы — но и ко всем частям системы — разделенным или нет.
Например, в смеси частиц различных типов, скажем молекул различного газа, каждый тип частиц будет находиться в равновесии с другими. То есть, они будут иметь одинаковую температуру — одинаковую среднюю кинетическую энергию. Если каждый тип частиц имеет отличную от других массу, то каждый из них должен иметь уникальную среднюю скорость для того, чтобы кинетические энергии каждого типа были равными. Одним из последствий этого является то, что когда газ становится ионизированным, выбитые свободные электроны становятся отдельными частицами и приходят в состояние термодинамического равновесия с ионами и ионизированными атомами. Поскольку они намного легче, чем атомы или ионы, их скорость будет намного выше.
Мы также уже применили принцип равновесия при выводе Закона Идеального Газа. Полная кинетическая энергия была разделена поровну между тремя пространственными направлениями движения, например они были в равновесии друг с другом. Эти пространственные направления называются «степенями свободы» одноатомного идеального газа. Поскольку кинетическая энергия частицы в таких газах равна , для каждой степени свободы приходится по
энергии на частицу. Это также верно для многоатомных газов, которые имеют дополнительные степени свободы (например от вибрации и вращения). В состоянии равновесия каждая доступная степень свободы будет иметь к
энергии. Это — теорема о равномерном распределении энергии.
Фактическое количество доступных степеней свободы в многоатомных газах может значительно меняться с температурой в силу квантово-механических соображений. Каждая степень свободы имеет характерную энергию возбуждения, и если значение не является достаточно большим, то возбуждение данного состояния будет пренебрежимо малым.
3.1.4 Релаксация
Чтобы достичь равновесия между различными частицами и различными степенями свободы в системе, различные ее части должны быть способными обмениваться энергией. Скорость обмена энергией определяет, как много времени уйдет на установление равновесия. Длительность этого периода уравновешивания называется временем релаксации системы. Сложная система, как правило, имеет несколько времен релаксации для различных своих компонент.
Чем дальше степень свободы от равновесия, тем быстрее она будет сходиться к равновесному состоянию. Наоборот, по мере приближения к равновесию, скорость сходимости уменьшается. Это выражается стандартным уравнением релаксации:
3.1.4-1
где является мерой текущей энергии степени свободы (средняя кинетическая энергия, температура, число возбужденных частиц и т.д.),
— равновесное значение и
— время релаксации.
Решение этого линейного дифференциального уравнения показывает нам, что разница между текущим состоянием и состоянием равновесия экспоненциально уменьшается с течением времени:
3.1.4-2
За каждый интервал времени разница
уменьшается множителем
. Хотя, согласно этому уравнению, полное равновесие формально никогда не будет достигнуто, через конечное (обычно небольшое) число интервалов релаксации отличие от равновесия становится незаметным.
Что определяет значение ? Оно определяется тем, как часто можно ожидать события, при котором элемент степени свободы подвергается обмену энергией, и насколько эффективно это событие в отношении передачи энергии. Для частиц с близкой массой единственное столкновение может передать практически всю кинетическую энергию от одной частицы к другой. Время релаксации для приведения в равновесие двух популяций частиц с различными кинетическими энергиями является, таким образом, средним временем между столкновениями. В воздухе при нормальных температурах и давлениях, это время составляет около 0.1 наносекунды. При более высоких плотностях и температурах расстояния, проходимые между столкновениями, являются более короткими, а скорости больше, поэтому время релаксации, соответственно, короче.
Если сталкивающиеся частицы имеют существенно различные массы, то эффективность каждого столкновения в обмене энергией уменьшается множителем, равным отношению масс. В случае электронов и ионов, поскольку электроны легче, чем нуклоны в 1836 раз (примерно), это отношение составляет , где
— атомная масса. Хотя если температура электронов не намного холодней, чем у ионов, фактически относительная скорость релаксации намного выше, чем можно было бы ожидать из-за высокой скорости легких электронов. Если они не слишком далеки от равновесия, реальное отношение между временами релаксации электронов c ионами и только ионов приблизительно равно квадратному корню из отношения масс:
.
3.1.5 Закон распределения Максвелла-Больцмана
До сих пор мы говорили о средней скорости и кинетической энергии частицы. В действительности, ни одна частица не будет иметь в точности такую среднюю энергию. Даже если бы мы создали такую систему, в которой каждая частица первоначально имела точно такую энергию (все были средними), в пределах одного интервала релаксации эта энергия была бы драматически перераспределена. В течение нескольких интервалов было бы установлено непрерывное распределение энергии.
Статистическая механика показывает, что равновесное распределение энергии частиц может быть описано законом распределения, разработанным вначале Максвелла и уточненным Больцманом. Эта функция создает примерно колокол-образную кривую с максимумом (наиболее вероятной) энергии при . Эта функция экспоненциально убывает от максимума, но никогда (формально) не приходит к нулю при любой энергии больше нуля, так что в равновесном газе находится небольшое количество как очень быстрых, так и очень медленных частиц. Распределение энергии Максвелла-Больцмана выглядит так:
3.1.5-1
где — число присутствующих частиц. Интегрирование этого уравнения по заданному диапазону энергий дает число частиц в этом диапазоне.
Большинство членов в этом уравнении являются просто нормализующими множителями, чтобы интеграл получился правильным (в конце концов, интеграл от нуля энергии до бесконечности должен быть равен ). Множитель, который фактически определяет этот закон распределения, называется фактором Больцмана:
. Этот фактор распределения относится к любой системе частиц, в которой каждое энергетическое состояние в равной степени важно в статистическом смысле (то есть, к энергетическим состояниям не применяются никакие статистические веса). Газ, где это действительно так (подобно газам классической кинетической теории) можно назвать газом Больцмана. Есть два других типа газов, которые следуют различным законам распределения и которые будут обсуждаться позже — Бозе-газ и Ферми-газ.
Ниже представлен график для плотности распределения частиц Максвелла-Больцмана, при
. Пиковым значением
является энергия частицы
, но поскольку распределение плотности энергии пропорционально
, то максимумом плотности распределения энергии, на самом деле, является
.
Рисунок 3.1.5-1. Плотность распределения Максвелла-Больцмана энергии частиц
3.1.6 Теплоемкости и Термодинамический показатель
Закон Идеального Газа описывает свойства газов в зависимости от температуры, то есть кинетической энергии движения. Как мы описываем свойства газа в связи с полной внутренней энергией ? В случае одноатомного газа это конечно легко, поскольку кинетическая энергия является полной внутренней энергией:
Но как мы должны обращаться с многоатомными газами ? Прежде, чем мы сможем сделать это, нам нужен некоторый удобный способ измерения термодинамических свойств различных газов.
Как я уже объяснил выше, идеальный газ с дополнительными степенями свободы имеет большую внутреннюю энергию, чем одноатомный газ при той же температуре. Эта внутренняя энергия, обозначенная , также пропорциональна (абсолютной) температуре (это другой распространенный способ выражения концепции идеального газа). Это позволяет нам установить для каждого газа константу, которая описывает, сколько тепловой энергии требуется, чтобы повысить его температуру на фиксированную величину. Эта константа называется теплоемкостью.
На самом деле есть два, широко используемых определения удельной теплоемкости газов: теплоемкость при постоянном объеме () и удельная теплоемкость при постоянном давлении (
).
измеряет количество энергии, требуемое для повышения температуры в закрытом контейнере с фиксированным объемом. В таком контейнере нагревание также заставляет давление расти.
измеряет количество энергии, требуемое для повышения температуры газа, которому позволено расширятся для поддержания постоянного давления.
Эти две теплоемкости не являются независимыми. На самом деле, отношение между ними фиксируется числом степеней свободы газа. Это дает нам константу, которую мы используем для описания термодинамических свойств газа – термодинамический показатель. Эта константа представляется строчной греческой буквой гамма. Она определяется по формуле:
3.1.6-1
и равна 5/3 для одноатомного газа. Термодинамический показатель имеет множество других имен, таких как показатель адиабаты, адиабатический индекс, изэнтропический показатель и политропный показатель.
Напомним, что плотность внутренней энергии одноатомного газа () дается формулой:
Поскольку одновременно является полной внутренней энергией, то мы можем сказать:
3.1.6-2
Возникает множитель 2/3, который равен гамма минус 1 : 5/3 — 1 = 2/3. Это частный случай закона, который справедлив для всех идеальных газов. Таким образом, можно записать общий закон:
3.1.6-3
Почему гамма называется термодинамическим или адиабатическим показателем? Это из-за следующего соотношения, которое описывает состояние вещества, подвергающегося адиабатическому сжатию:
3.1.6-4
Эта постоянная определяется исходной энтропией газов. Иногда это называют политропным законом. Термодинамический показатель определяется сжимаемостью газа. Чем больше значение гаммы, тем больше работы требуется для того, чтобы сократить объем через адиабатическое сжатие (и тем больше увеличение внутренней энергии). Бесконечно сжимаемый газ будет иметь показатель 1.
В термодинамической литературе часто используются PV — диаграммы, которые отображают давление (Р) против объема (V). График адиабатической функции на PV — диаграмме производит адиабатическую кривую, которая также называется изэнтропической кривой, поскольку каждая точка на этой кривой имеет одну и ту же энтропию. В отличие от этого, изотермические кривые лежат ниже адиабаты с ростом давления (если начинаются с того же состояния PV), поскольку для сохранения температуры газ должен терять энтропию. Кривые, где энтропия увеличивается с увеличением давления, лежат выше (это кривые Гюгонио (Hugoniot), которые будут обсуждаться в связи с ударными волнами).
Гамма для газа связана с числом степеней свободы посредством:
3.1.6-5
Таким образом, для одноатомного идеального газа 2/3 + 1 = 5/3, как было отмечено выше. Двухатомный газ имеет максимум 7 степеней свободы, но только некоторые из них могут быть возбуждены при данной температуре, c большим числом состояний, возбуждающихся при более высоких температурах.
Если газ высвобождает энергию при сжатии, добавляя тем самым дополнительную кинетическую энергию (за счет химической реакции, например), то он будет иметь более высокое значение гамма. Некоторые примеры значений гамма приведены в таблице ниже.
|
Таблица 3.1.6-1 Примеры термодинамических показателей для газов |
||
| Вещество | Точное значение | Приближенное значение |
| Газовая смесь детонирующей взрывчатки | - | 2.5-3.0 |
| Идеальный одноатомный газ | 5/3 | 1.667 |
| Воздух | 7/5 | 1.400 |
| Фотонный газ | 4/3 | 1.333 |
| Двухатомный газ (полностью возбужденный) | 9/7 | 1.286 |
| Бесконечно сжимаемый газ | 1/1 | 1.000 |
3.1.7 Свойства чернотельного излучения
Равномерное распределение энергии в равновесной системе также распространяется на энергию излучения, присутствующего в системе. Фотоны непрерывно испускаются и поглощаются веществом, создавая равновесный фотонный газ, который пронизывает его. Этот фотонный газ должен иметь ту же температуру, что и вся остальная система.
Распределение энергии в равновесном фотонном газе определяется квантово-механическими принципами, известными как статистика Бозе-Эйнштейна. Фотоны принадлежат к классу частиц, называемых бозонами, которые, по определению, подчиняются этой статистике. Ключевой особенностью бозонов является то, что они предпочитают находиться в том же энергетическом состоянии, что и другие бозоны. Фотонный газ, таким образом, является примером Бозе-газа. Фактором распределения для статистики Бозе-Эйнштейна является:
Этот факт приводит к распределению энергии между частицами фотонного газа, называемому спектром черного тела, которое имеет зависящий от температуры пик, напоминающий распределение Максвелла-Больцмана. Термин «черное тело» относится к аналитической модели, использованной для того, чтобы математически получить этот спектр, которая предполагает наличие идеального поглотителя фотонов или (эквивалентно) герметичного контейнера энергии (называемого по-немецки «hohlraum»).
Кинетическая теория газов может быть применена к фотонному газу так же легко, как к газу с любыми другими частицами, но нам нужно сделать несколько корректировок. Из уравнения. 3.1.1-1 у нас было:
Что дает нам уравнение 3.1.1-3:
как только мы подставили для представления импульса частицы. Поскольку фотоны имеют нулевую массу, мы должны использовать другое выражение, чтобы выразить импульс фотона. Он определяется по формуле:
3.1.7-1
где — это энергия фотона,
— скорость фотона (т.е. скорость света,
см/сек). Интересно сравнить это с эквивалентным выражением для импульса массивных частиц:
. Подставляя уравнение 3.1.7-1 и скорость фотона в уравнение 3.1.1-3, получим:
3.1.7-2
Поскольку есть просто плотность энергии фотонного газа, то мы можем сказать:
3.1.7-3
Из уравнения 3.1.6-3 видно, что:
3.1.7-4
Мы можем связать плотность энергии черного тела с испусканием теплового излучения (потоком энергии) с его поверхности (или из окна в энергетическом контейнере). Предполагая энергетическое поле изотропным, этот поток является просто произведением плотности энергии и средней скорости, с которой фотоны покидают излучающую поверхность. Конечно, все фотоны имеют общую скорость равную , но только фотоны, испускаемые по нормали к этой поверхности (под прямым углом к ней) удаляются от нее с этой скоростью. Эффективная скорость покидания поверхности равна
, где
есть угол между лучом света и вектором нормали. Средняя эффективная скорость удаления фотонов (по нормали к поверхности) дается выражением:
Поскольку лишь половина испускаемых фотонов движется в направлении от поверхности (другая половина движется в обратном направлении), то в результате получаем:
3.1.7-5
где есть величина потока (излучения с единицы площади в единицу времени).
В состоянии равновесия плотность энергии излучения определяется только температурой, мы хотим поэтому иметь способ связать температуру с плотностью энергии
. Используя уравнение 3.1.7-3 и математически точную формулировку второго начала термодинамики легко показать, что
пропорционально
. Стандартный коэффициент пропорциональности, называемый постоянной Стефана-Больцмана и обозначаемый сигма, определяется так, что:
3.1.7-6
Это удобный способ определить постоянную, поскольку он позволяет нам сказать:
3.1.7-7
Уравнение 3.1.7-7 известно, как Закон Стефана-Больцмана. Постоянная Стефана-Больцмана получается из постоянной Планка и скорости света. Она имеет значение эрг/(сек*кв.см*К), где
— температура в Кельвинах K. Уравнение 3.1.6-3, конечно, будет выглядеть так:
3.1.7-8
Из закона Стефана-Больцмана легко видеть, что количество присутствующей лучистой энергии драматически меняется с температурой. При комнатной температуре оно незначительно, но растет очень быстро. При достаточно высоких температурах энергия, присутствующая в чернотельном поле, превосходит все другие формы энергии в системе (о которой тогда говорят, как о «радиационно доминированной»). Средняя энергия фотона прямо пропорциональна , это означает, что плотность фотонов изменяется как
. В веществе, где доминирует излучение, мы можем ожидать, что число присутствующих фотонов будет больше, чем число всех остальных частиц, вместе взятых.
Если одновременно присутствуют обычные частицы и фотоны, то мы имеем смесь газов Больцмана и Бозе. Каждый из них независимо вносит свой вклад в плотность энергии и давление газовой смеси. Поскольку для идеального газа:
и
3.1.7-9 имеем
3.1.7-10 и
3.1.7-11
Мы можем рассчитать относительные кинетический и радиационный вклады в давление и энергию при различные плотностях частиц и температурах. Например в водороде, при его нормальной жидкой плотности, плотность энергии излучения равна кинетической энергии ионизованного газа при градусах Кельвина
Распределение энергии поля излучения по энергиям фотонов определяется законом Планка, который обычно формулируется в терминах частоты фотонов вместо энергии. Энергия фотона с частотой есть просто:
3.1.7-12
где дано в герцах (с/длину волны), а постоянная Планка (
эрг*сек). Закон Планка (иначе функция Планка), как правило, дается в виде:
3.1.7-13
где — производная от плотности энергии по частоте. Последний множитель в уравнении, конечно, является фактором распределения Бозе-Эйнштейна. Интегрирование по диапазону изменения
дает плотность энергии в этом диапазоне частот. Для наших целей часто удобней выразить плотность энергии в терминах энергия фотона, а не частоты:
3.1.7-14
Распределение Планка всегда имеет свой пик (максимум спектральной мощности) при , в то время как 50% энергии переносится фотонами с энергией больше
, и 10% с энергией больше
. Большая часть энергии этого поля, таким образом, переносится фотонами с энергией намного большей, чем средняя кинетическая энергия частиц.
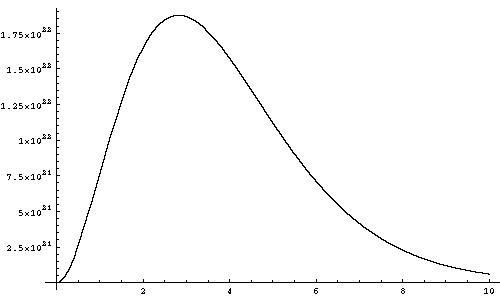
Ниже приведен график функции Планка при температуре 1 кэВ, изображающий зависимость спектральной плотности энергии от энергии фотонов в КэВ.
Рисунок 3.1.7-1. Спектр абсолютно черного тела.
Если Вас заинтересовала книга Кэри Саблетта и Вам хотелось бы продолжить ее чтение, не дожидаясь окончания перевода, то все NWFAQ-s находятся здесь: http://nuclearweaponarchive.org/Nwfaq/Nfaq0.html.
вернуться к началу книги и списку опубликованных секций http://extremal-mechanics.org/archives/3047 .